以抗PD-1单抗等免疫检查点抑制剂(ICB)为代表的肿瘤免疫疗法,通过激活体内免疫系统发挥抗肿瘤作用,已经广泛用于一系列癌症的治疗。然而,不同患者的疗效存在巨大差异,仍有大量癌症患者无法从ICB治疗中获益。
肠道菌群是影响ICB疗效的重要环境因素。不同肿瘤患者的肠道菌群组成不同,粪菌移植(FMT)已被证明能改善 ICB 的反应性。尽管越来越多的研究揭示了特定菌株可影响 ICB疗效,但具体的起效成分和内在机制仍有待阐明。
肿瘤微环境中浸润的T细胞在 ICB 治疗中发挥关键作用。最近的研究表明,高表达转录因子T细胞因子1(TCF-1,由TCF7编码)、具有免疫干性特征的衰竭前体CD8+ T细胞(Tpex)是响应抗PD-1单抗免疫治疗的关键亚群。Tcf7敲除鼠会伴随肠道菌群失衡,但特定菌株及其代谢物能否调节免疫细胞干性增敏免疫治疗还未有报道。
2024年3月14日,浙江大学医学院附属第二医院王良静教授团队和附属邵逸夫医院陈淑洁主任医师团队合作在《细胞》(Cell)上发表了题为Microbial metabolite enhances immunotherapy efficacy by modulating T-cell stemness in pan-cancer的研究论文,利用多组学测序和生物信息分析发现共生约氏乳酸杆菌和生孢梭菌合作代谢色氨酸,产生的衍生物吲哚丙酸(IPA)可调控“干细胞样”TCF-1+ Tpex 细胞,促进效应细胞分化,增敏免疫治疗。研究者还在结直肠癌、乳腺癌、黑色素瘤等多种小鼠肿瘤模型和肿瘤患者来源的类器官上进行了验证,有望为基于微生态的免疫治疗辅助方案提供新策略。

在这项研究中,作者首先发现小鼠中存在着和临床实践类似的免疫治疗“反应”鼠和“反应差”鼠,基于粪菌移植验证了肠道菌群可影响肿瘤免疫治疗疗效。通过粪便菌群测序、筛选,研究者分离了一株在“反应”鼠和“反应差”鼠之间丰度差异明显的约氏乳酸杆菌(L. johnsonii)。灌胃约氏乳酸杆菌可增加CD8+ T细胞浸润,增敏抗PD-1单抗疗效。
▲研究设计示意图(图片来源:参考资料[1])
约氏乳酸杆菌增强肿瘤免疫疗效的起效成分是什么?研究者对此进行探究,发现菌源性代谢物可能发挥关键作用。利用非靶向代谢质谱,研究者锁定了色氨酸代谢通路,并结合色氨酸缺乏饮食、高效液相色谱串联质谱联用技术确定了起效的关键成分:吲哚丙酸。
随后,研究者进一步揭示了吲哚丙酸增强免疫疗效的机制。实验表明,约氏乳酸杆菌及其衍生的吲哚丙酸依赖CD8+ T细胞发挥增敏免疫治疗的作用,对小鼠灌胃吲哚丙酸后,“干细胞样”衰竭前体CD8+ T细胞(Tpex)和效应CD8+ T细胞的比例显著增加。进一步的测序发现,吲哚丙酸可增强 Tcf7 超级增强子区域的 H3K27 乙酰化,以此调控“干细胞样”TCF-1+ Tpex 细胞,促进效应细胞分化,从而增敏免疫治疗。
下一个问题是,约氏乳酸杆菌是如何产生吲哚丙酸的?有趣的是,研究者在体外约氏乳酸杆菌培养上清液中无法检测到吲哚丙酸产生,反而检测到吲哚丙酸的上游代谢物吲哚乳酸(ILA)。基于抗生素鸡尾酒模型和腹腔注射模型,研究者猜想约氏乳酸杆菌产生的吲哚乳酸在体内被其他肠道菌群进一步代谢为吲哚丙酸来发挥作用。
随后,作者在无菌鼠模型中验证了这一猜想。单独定植约氏乳酸杆菌只能产生大量的吲哚乳酸;而与另一种梭菌属成员生孢梭菌(C. sporogenes)联合定植,无菌鼠可大量产生吲哚丙酸,增敏免疫治疗疗效。作者预测约氏乳酸杆菌产生吲哚乳酸的关键酶ldhA,并在大肠杆菌中进行异源表达证实了这一猜想:过表达ldhA酶的大肠杆菌可以增加吲哚丙酸产生,增敏小鼠免疫治疗。
最后,研究者在多种小鼠肿瘤模型(乳腺癌皮下瘤模型、 乳腺脂肪垫原位癌模型、MMTV-PyMT自发瘤模型、黑色素瘤皮下移植模型、盲肠袋原位癌模型)和结直肠癌患者来源的类器官上验证了吲哚丙酸对Tpex细胞和免疫治疗的调控作用。
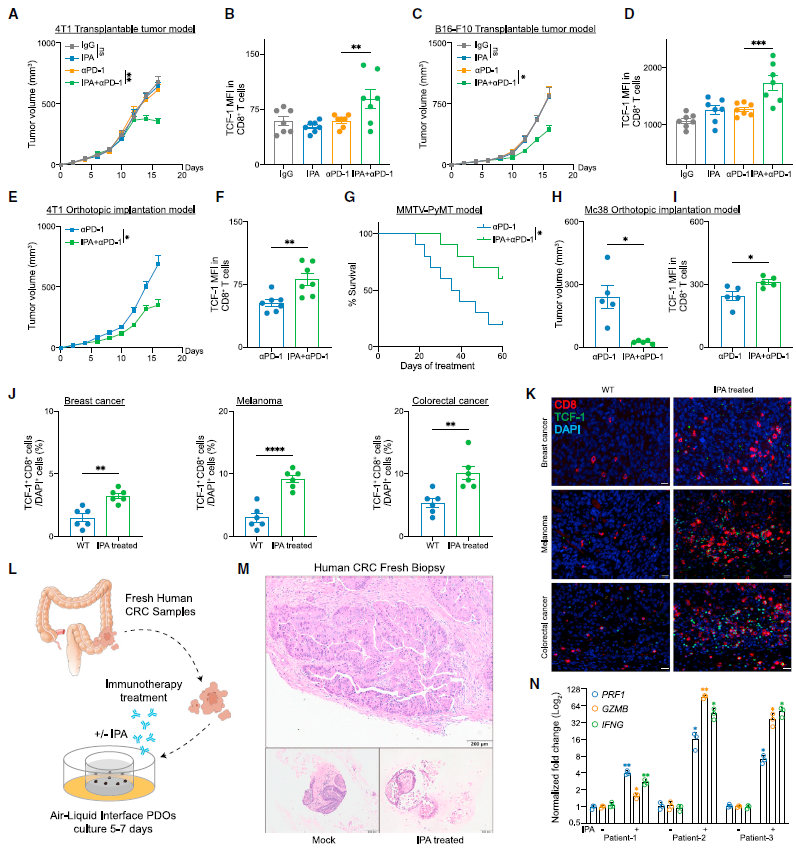
▲在小鼠肿瘤模型和类器官中,吲哚丙酸增强了对ICB的应答。(图片来源:参考资料[1])
综上,本工作揭示了一种由不同细菌合作产生的色氨酸衍生物,阐明了吲哚丙酸通过组蛋白乙酰化修饰调控免疫干性关键转录因子的机制,并在泛癌水平验证了吲哚丙酸增敏免疫治疗的作用。这条菌源性代谢物-宿主免疫调节途径为增敏免疫治疗提供了潜在的新思路。
浙江大学医学院附属第二医院王良静教授和浙江大学医学院附属邵逸夫医院陈淑洁主任医师为本文通讯作者。浙江大学研究生贾丁佳成、王其温、戚亚东、姜堯、何嘉敏为共同第一作者。本研究得到浙大姒健敏教授、王迪教授、朱永群教授、汪洌教授等的支持与帮助,得到浙大二院各公共实验平台、邵逸夫医院各公共实验平台、浙江大学各公共实验平台、浙江省农科院质谱检测平台等的支持。本研究受到国家自然科学基金面上项目、浙江省自然科学基金重点项目、国家重点研发计划子课题的资助。
浙江大学医学院王良静/陈淑洁课题组长期从事肠道微生态与肠道疾病发生发展和干预机制研究,搭建了从生物样本库和人群队列、菌株库和模式生物研究的研究转化平台,成功筛选、分离并建立了一系列具有自主知识产权的共生菌株库。近3年原创工作发表在 Cell, Nat Aging, Nat Commun (2022, 2023), J Clin Invest, Adv Sci 等国际高水平期刊。
参考资料:[1] Jia et al., Microbial metabolite enhances immunotherapy efficacy by modulating T cell stemness in pan-cancer. Cell (2024). DOI: 10.1016/j.cell.2024.02.022
免责声明:本页面信息为第三方发布或内容转载,仅出于信息传递目的,其作者观点、内容描述及原创度、真实性、完整性、时效性本平台不作任何保证或承诺,涉及用药、治疗等问题需谨遵医嘱!请读者仅作参考,并自行核实相关内容。如有作品内容、知识产权或其它问题,请及时联系我们处理!原文链接:https://new.qq.com/rain/a/20240324A030LB00


