学术经纬 2024-04-19 08:03发布于江苏药明康德旗下药明在线官方账号
▎药明康德内容团队编辑
巨噬细胞不仅是清除病原微生物的免疫细胞,也在肿瘤微环境中扮演重要角色。肿瘤中有数量丰富、类型多样的巨噬细胞,其中占据大部分的是促进肿瘤生长、导致药物抵抗的类型,也有能够抑制肿瘤生长的类型。因此,巨噬细胞被认为是将免疫应答较弱的”冷肿瘤”转变为”热肿瘤”的关键。
2024年4月18日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)王红艳研究员、上海大学魏滨教授、复旦大学唐惠儒教授、上海交通大学叶幼琼研究员合作领衔的研究团队在Immunity杂志发表论文,揭示了肿瘤免疫治疗的代谢新靶点——胆固醇25-羟化酶(cholesterol-25-hydroxylase, CH25H)。新研究显示,敲除巨噬细胞的CH25H,可增强肿瘤微环境中T细胞的数量并活化其杀伤功能,将“冷肿瘤”转变成“热肿瘤“,提高anti-PD1单抗等免疫疗法的抗肿瘤效果。

新研究发现,肿瘤相关巨噬细胞(TAM)等免疫抑制型巨噬细胞会被诱导高表达胆固醇氧化酶CH25H,从而导致胆固醇氧化生成的25-羟基胆固醇(25-HC)累积。实验显示,细胞因子IL-4和IL-13刺激的M2型巨噬细胞、TAMs及肿瘤组织中氧化固醇25-HC的水平升高。与此一致的是,单核RNA测序(scRNA-seq)分析已发表的数据,也发现多种实体肿瘤组织中特定TAMs高表达CH25H,且与患者预后负相关。
进一步分析显示,累积的25-HC聚集在巨噬细胞的溶酶体,与胆固醇竞争结合溶酶体定位的信号蛋白GPR155,抑制激酶mTORC1活化,从而导致AMPKa激活和代谢重编程。而AMPKa活化增强,使得转录因子STAT6第564位丝氨酸磷酸化,造成STAT6转录活性增强,最终促进巨噬细胞产生更多精氨酸酶(Arg1)和抑炎因子,导致肿瘤发展加速。
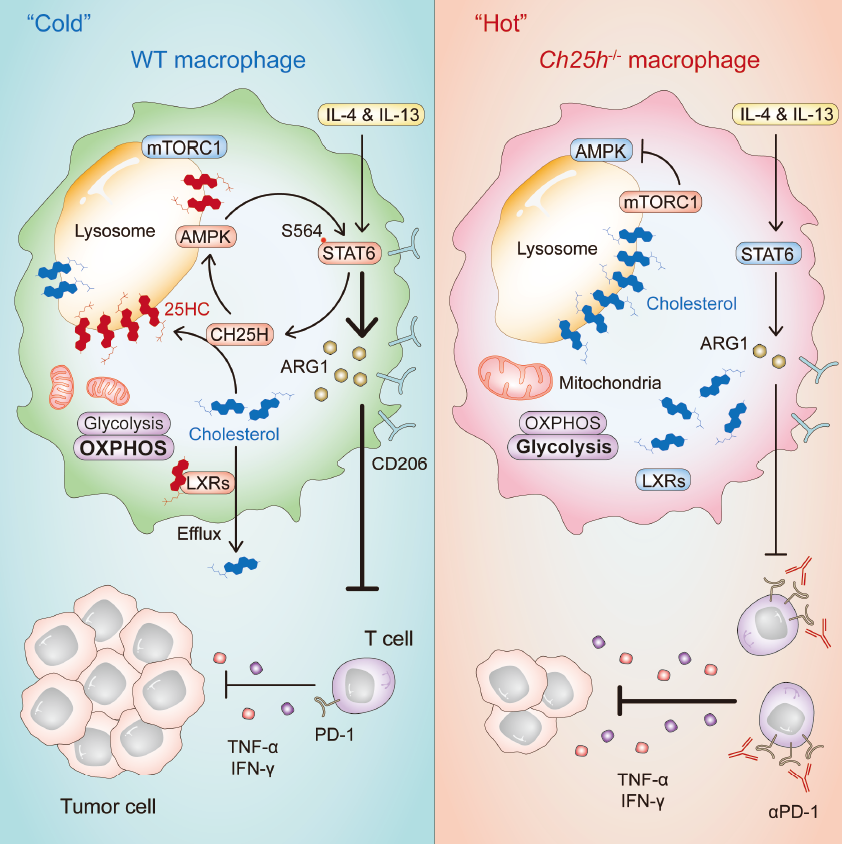
▲靶向巨噬细胞的CH25H激活“冷肿瘤”的研究示意图(图片来源:参考资料[1])基于这些发现,研究人员在巨噬细胞中敲除了Ch25h,发现可以逆转TAM的免疫抑制功能,阻断多种皮下肿瘤的发展,并伴有肿瘤组织中增强的T细胞浸润和活化及高表达免疫检查点PD-1。这表明,联合使用anti-PD1单抗可以进一步增强抗肿瘤效果。
研究人员指出,这项工作率先提出了氧化固醇和胆固醇定位在溶酶体并相互制衡以调控巨噬细胞命运的概念,并将胆固醇氧化酶CH25H和氧化固醇25-HC从感染领域拓展到肿瘤免疫治疗领域。
中国科学院分子细胞科学卓越创新中心肖俊副研究员(现任南通大学附属医院研究员),国科大杭州高等研究院王爽博士后和复旦大学生命科学学院陈龙龙是本文的共同第一作者。中国科学院分子细胞科学卓越创新中心惠利健研究员和同济大学附属东方医院胡淼医生在临床样本上提供了帮助。
参考资料:
[1] Xiao et al., 25-Hydroxycholesterol regulates lysosome AMP kinase activation and metabolic reprogramming to educate immunosuppressive macrophages, Immunity (2024), https://doi.org/10.1016/j.immuni.2024.03.021
免责声明:本内容来自互联网平台创作者,不代表本博客和平台的观点和立场。
原文链接:https://new.qq.com/rain/a/20240419A00V9F00